イーピーエス株式会社
株式会社EP綜合
イーピーエス株式会社(本社:東京都新宿区、代表取締役 山田 剛久 、以下 「EPS」 )と株式会社EP綜合(本社:東京都新宿区、代表取締役:山本 賢一、以下 「EP綜合」)は、eConsentを導入したDCTの現状をテーマに治験の現場での現状について、2024年3月13日に共催Webセミナーを開催いたしました。

本セミナーへの参加人数は491名となり、eConsentの医療機関側での受け入れ状況や、円滑な導入を進める上でのケーススタディに対する製薬企業の興味の高さがうかがえました。
セミナーでは、「治験及び製造販売後臨床試験における電磁的方法を用いた説明及び同意に関する留意点について(令和5年3月30日薬生薬審発0330第6号・薬生機審発0330第1号)」の発出により、eConsentの導入環境が、実際の治験の現場でどのように変化しているかについて紹介するとともに、EP綜合所属のCRC*3へのアンケートから、より円滑な導入を進めるために明らかになりつつある新たな課題について紐解きました。また、Virtual Go構想を掲げるEPSによるeConsent導入のオペレーション観点でのCRO*4業務支援のほか、SMO*5のEP綜合がIRB*6事務局へ行う導入支援の事例についても紹介しました。
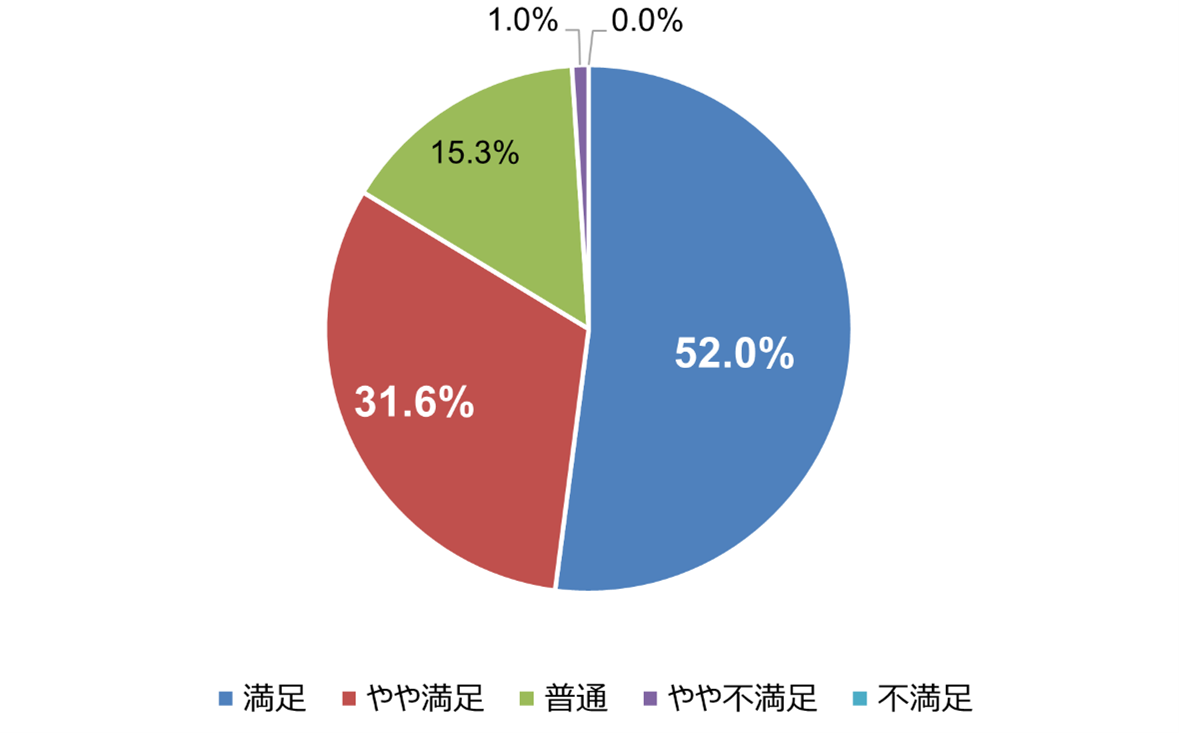
セミナー参加者への満足度調査(n=98)では、「満足」と「やや満足」の合計が83.6%と高いご評価をいただきました。
■EPSの「Virtual Go」構想
EPS は臨床試験業務支援のリーディングカンパニーとして、これまで培ってきたデータサイエンスに関する専門性や豊富な経験・実績をもとにDCTを推進していく「Virtual Go」構想を進めています。

「Virtual Go」とは、EPS がDCTを推進していくためのサービス総称です。
「治験参加者が施設へ訪問しなくてもよいバーチャル」と、「CRA*7 が施設へ訪問しなくてもよいバーチャル」を念頭に、eConsentをはじめとした、オンライン診療、DDC*8、eCOA*9、ウェアラブルデバイスの活用、治験薬配送、訪問看護、検体回収などさまざまなスキームについて、試験デザインや疾患領域に合わせて EPS がトータル的に提案・運用・管理を行い、DCTを推進します。
■イーピーエス株式会社について(https://www.eps.co.jp)
イーピーエス株式会社は1991年に事業を開始し、治験やPMS*10を中心とした臨床試験を総合的に支援するCROです。臨床試験を推進する機能のすべての入口となる「Trial GATE」というコンセプトに基づき、さまざまな領域、フェーズの試験において医療機関や患者と製薬企業の橋渡しとなり、患者中心の治験の在り方を追求して参ります。
■株式会社EP綜合について(https://www.ep-link.co.jp)
EP 綜合は1999年にSMO 事業を開始し、現在7,000近い治験実施施設(医療機関)と契約し、GCP*11に基づき適正な治験実施ができるよう、医療機関における治験業務を支援しています。 創業25年を迎える本年を新たな創業の期と捉え、4月1日に社名を「株式会社EPLink」に変更します。新たな気持ちで、治験実施環境の更なる向上へ貢献する新しい価値を創出し続け、最適なソリューションを提案します。
以上
【本件に関するお問い合わせ先】
イーピーエス株式会社 広報戦略室
E-mail: koho@eps.co.jp
*1 eConsent:Electronic Consent(電子的同意取得)
*2 DCT:Decentralized Clinical Trials(分散型臨床試験)
*3 CRC:Clinical Research Coordinator(治験コーディネーター)
*4 CRO:Contract Research Organization(医薬品開発業務受託機関)
*5 SMO:Site Management Organization(治験施設支援機関)
*6 IRB:Investigational Review Board(治験審査委員会)
*7 CRA:Clinical Research Associate(臨床開発モニター)
*8 DDC:Direct Data Capture(電子的な記録データの直接収集)
*9 eCOA:Electronic Clinical Outcome Assessment(電子臨床アウトカム評価)
*10 PMS:Post Marketing Surveillance(製造販売後調査)
*11 GCP:Good Clinical Practice(医薬品の臨床試験の実施の基準に関する省令)


