SMA
SMAは、治験事務局やIRBの設立支援、 GCPに定められた書式に則した書類作成、さらには関係者にGCPの主旨や内容をご理解いただくための啓発活動まで、 治験に必要な環境づくりをトータルにサポートします。多様なニーズにあわせ、全面支援から“ここだけ”のピンポイントまで対応いたします。
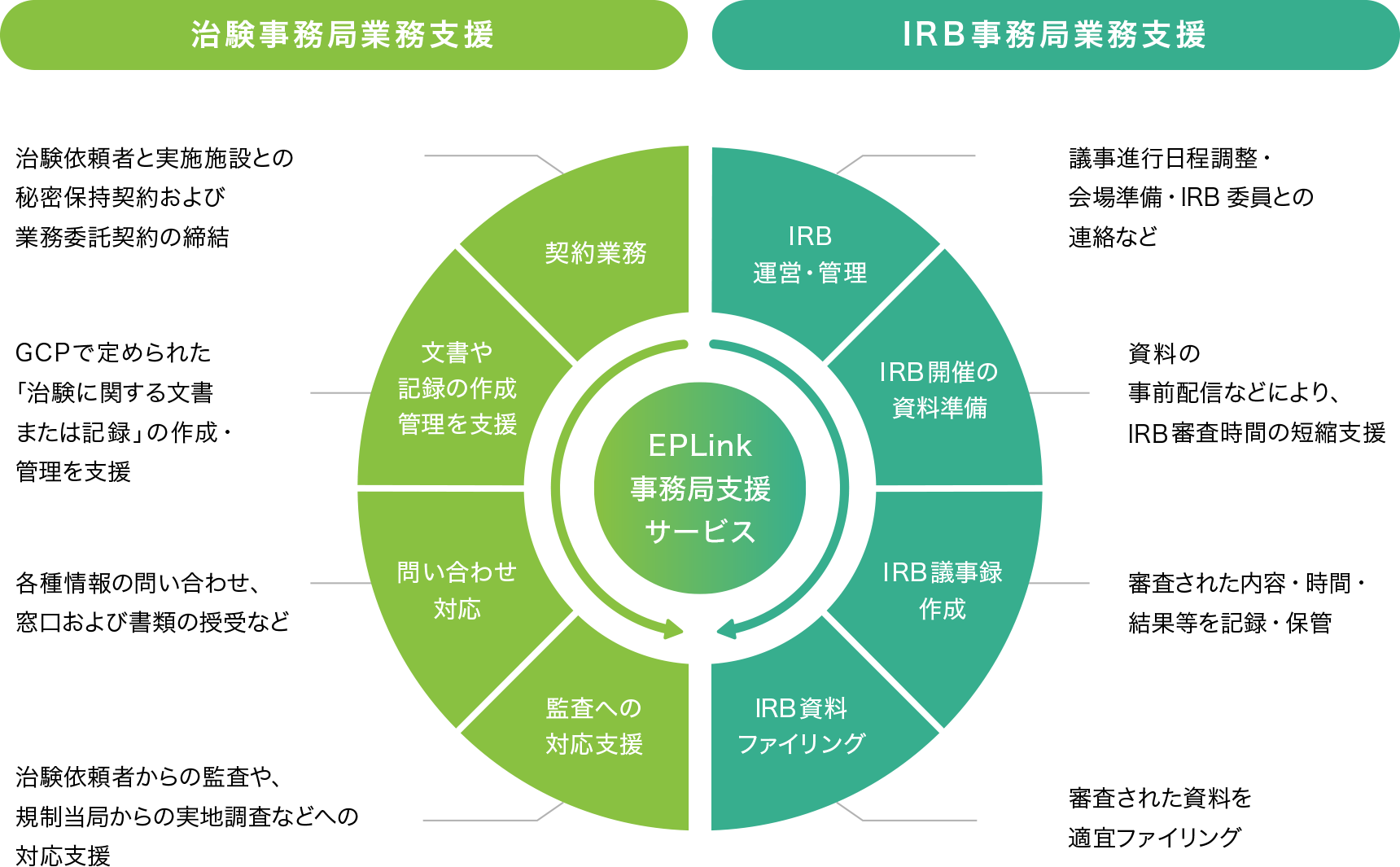
治験手続きに必要な書類作成・保管はもちろん、院内でIRB(治験審査委員会)を運営する場合、外部IRB(セントラルIRB※)で審査を行う場合それぞれにあわせて、最適な支援を行います。
医薬品や医療機器の治験だけでなく、臨床研究や再生医療等製品治験の事務局支援も可能です。
また、ご希望にあわせて各種資料の電子化・ペーパーレス化を実現する治験⽂書の電⼦管理クラウドシステム(DDTS)など、さまざまな選択肢をご用意しています。
IRB委員の負担軽減、医療機関内の省スペース化だけでなく、省資源、環境保護にもなり、ご好評をいただいています。
※セントラルIRB:複数の医療機関から委託された審査を一括して行う特定の医療機関のIRB
定期的な研修や法改正に応じた臨時研修の実施、また、事例検討会を通じて組織全体でノウハウやナレッジを共有することで、SMAのスキル向上や品質の均一化を図っています。 当社のSMAの7割は日本SMO協会が認定する公認SMAの資格保有者であり、その豊富な取り扱い経験から、医療機関の急な体制変更などにも迅速かつ的確に対応します。
業界に先駆けて、2001年にセントラルIRBを設立支援し、現在、当社は5つのセントラルIRBを支援しています。 大学病院、国公立病院などの大規模病院からも多数の審査受託実績があります。 医薬品や医療機器の治験だけでなく、再生医療等製品(※)の審査委託やIRB審査のみの委託も可能です。 実績(2022年10月~2023年9月):84開催 (プロトコル406本、新規679件、継続21,525件) ※2017年に再生医療等委員会の認定を取得